Среди терминов в электрике встречаются такие понятия как анод и катод. Это касается источников питания, гальваники, химии и физики. Термин встречается также в вакуумной и полупроводниковой электронике. Им обозначают выводы или контакты устройств и каким электрическим знаком они обладают. В этой статье мы расскажем, что это такое анод и катод, а также как определить где они находятся в электролизере, диоде и у батарейки, что из них плюс, а что минус.
В электрохимии есть два основных раздела:

Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны.
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде.
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду).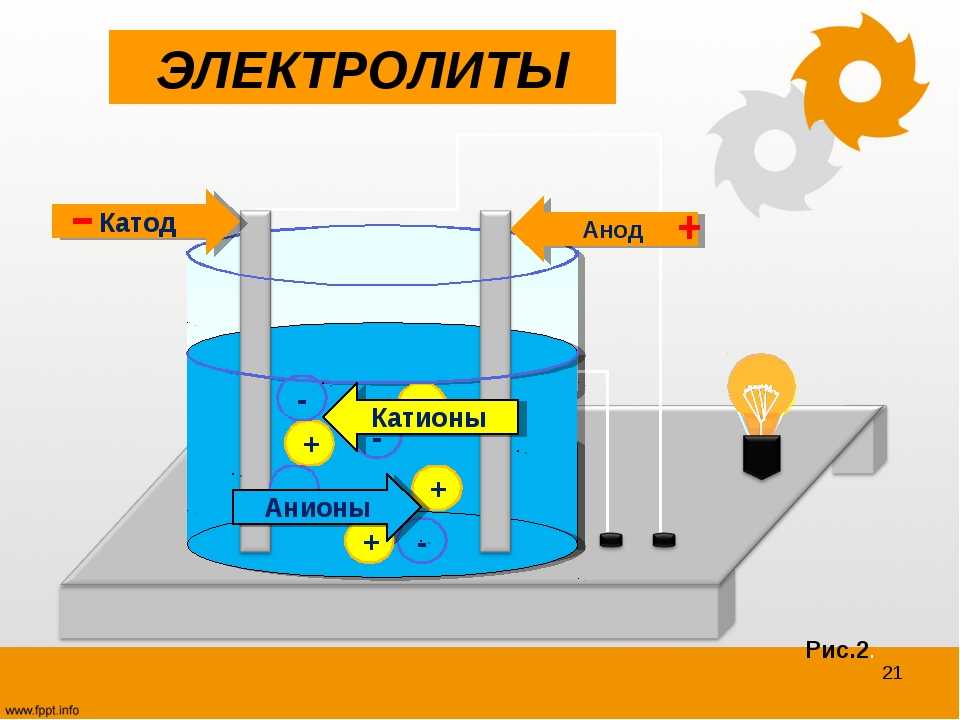 Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:
Эти процессы похожи и обратны гальваническому элементу, поскольку здесь не энергия поступает за счет химической реакции, а наоборот – химическая реакция происходит за счет внешнего источника электричества.
В этом случае плюс источника питания всё также называется катодом, а минус анодом. Зато контакты заряжаемого гальванического элемента или электроды электролизера уже будут носить противоположные названия, давайте разберемся почему!
Важно! При разряде гальванического элемента анод – минус, катод – плюс, при зарядке наоборот.
Так как ток от плюсового вывода источника питания поступает на плюсовой вывод аккумулятора – последний уже не может быть катодом. Ссылаясь на вышесказанное можно сделать вывод, что в этом случае электроды аккумулятора при зарядке условно меняются местами.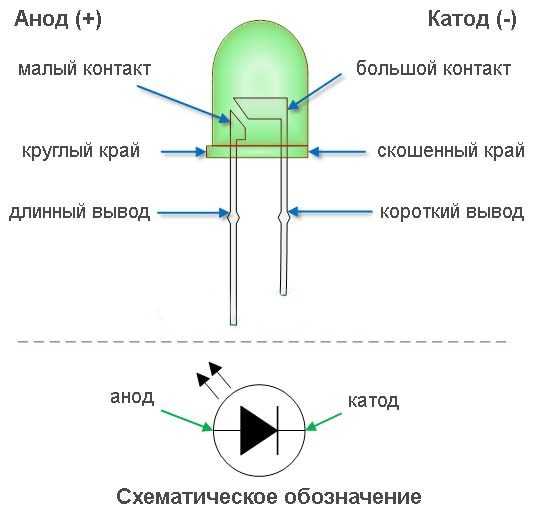
Тогда через электрод заряжаемого гальванического элемента, в который втекает электрический ток, называют анодом. Получается, что при зарядке у аккумулятора плюс становится анодом, а минус катодом.
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой. Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления).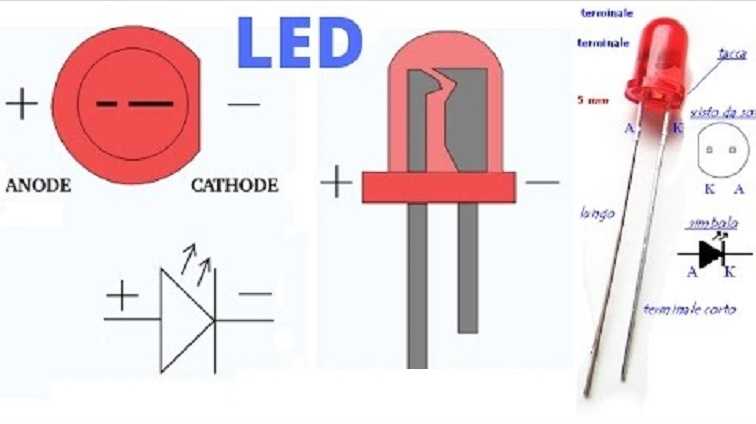 То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
Электроды или ножки полупроводниковых и вакуумных электронных приборов тоже часто называют анодом и катодом. Рассмотрим условное графическое обозначение полупроводникового диода на схеме:
Как мы видим, анод у диода подключается к плюсу батареи. Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
У светодиода аналогично. На 5 мм светодиодах внутренности видны через колбу. Та половина, что больше — это катод.
Также обстоит ситуация и с тиристором, назначение выводов и «однополярное» применение этих трёхногих компонентов делают его управляемым диодом:
У вакуумного диода анод тоже подключается к плюсу, а катод к минусу, что изображено на схеме ниже. Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
С пассивными элементами, такими как конденсаторы и резисторы дело обстоит иначе. У резистора не выделяют отдельно катод и анод, ток в нём может протекать в любом направлении. Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы. У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.
Итак, подведем итоги, ответив на вопрос: как запомнить где плюс, где минус у катода с анодом? Есть удобное мнемоническое правило для электролиза, заряда аккумуляторов, гальваники и полупроводниковых приборов. У этих слов с аналогичными названиями одинаковое количество букв, что проиллюстрировано ниже:
Во всех перечисленных случаях ток вытекает из катода, а втекает в анод.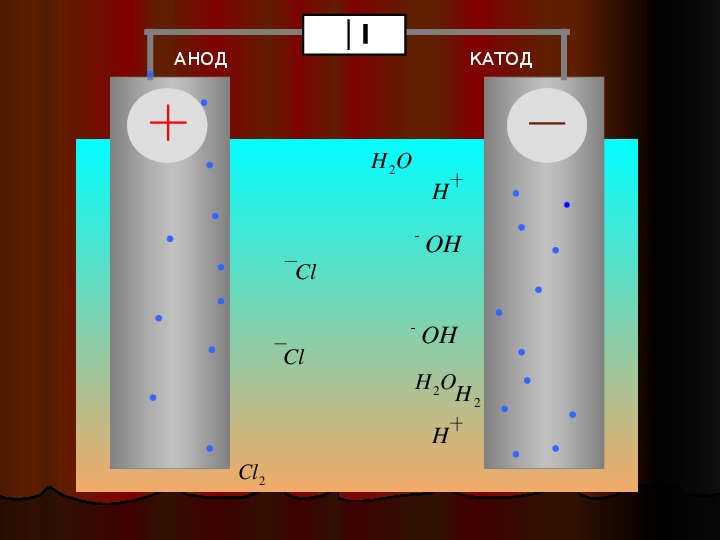
Пусть вас не собьёт с толку путаница: «почему у аккумулятора катод положительный, а когда его заряжают – он становится отрицательным?». Помните у всех элементов электроники, а также электролизеров и в гальванике – в общем у всех потребителей энергии анодом называют вывод, подключаемый к плюсу. На этом отличия заканчиваются, теперь вам проще разобраться что плюс, что минус между выводами элементов и устройств.
Напоследок рекомендуем просмотреть полезное видео по теме статьи:
Теперь вы знаете, что такое анод и катод, а также как запомнить их достаточно быстро. Надеемся, предоставленная информация была для вас полезной и интересной!
Материалы по теме:
Опубликовано 24.10.2018 Обновлено 24.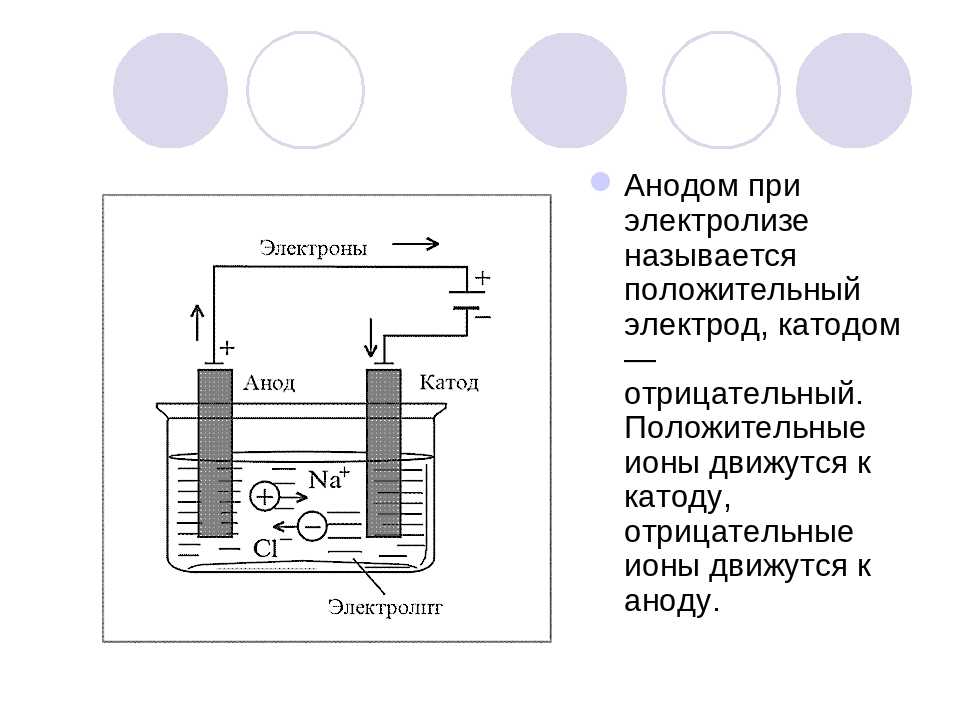
04 мая 2020г.
В последнее время были совершены важные открытия в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей. Эта работа помогла получить Нобелевскую химическую премию 2019 года за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» приобрели все большую важность.
В статьях о новых батарейных электродах и станциях циклирования батарей часто используются названия анод и катод без указания того, разряжается ли батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, их иногда можно спутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти разные термины.
Реакция окисления является электрохимической реакцией, которая производит электроны. Электрохимическая реакция, которая происходит на отрицательном элементе цинкового электрода никель-цинковой батареи во время разряда:
Электрохимическая реакция, которая происходит на отрицательном элементе цинкового электрода никель-цинковой батареи во время разряда:
Zn + 4OH— → Zn (OH) 2-4 + 2e—
реакция окисления. Окисление — это потеря электронов.
Реакция восстановления — это электрохимическая реакция, которая потребляет электроны. Электрохимическая реакция, происходящая на положительной стороне литий-ионного аккумулятора во время разряда:
Li1 — xCoO2 + XLI++ Xe— → LiCoO2
является реакцией восстановления. Сокращение — это выигрыш электронов.
 1).
1).Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом упоминается как положительный, электрод с более низким потенциалом упоминается как отрицательный. Электродвижущая сила, эдс в V батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.
Разряд батареи
Во время разряда напряжение элемента U, разность между положительным и отрицательным, уменьшается (рис. 2, 3).

Во время зарядки напряжение элемента U, разность между положительным и отрицательным, увеличивается (рис. 2, 3).
При обычном использовании перезаряжаемой батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода.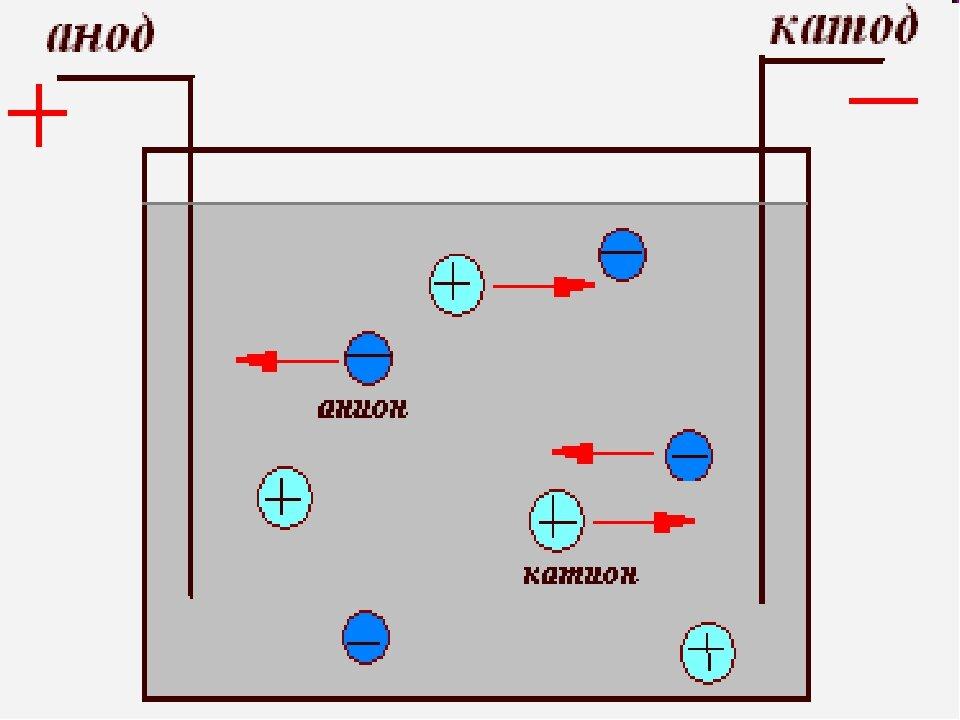 С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
Тексты, описывающие аккумуляторные аноды или катоды, безусловно, косвенно рассматривают случай разряда, что является неполным предсталением о процессах, происходящих внутри вторичного элемента.
Если вам было сегодня много лет, когда вы узнали, что такое анод и катод, вы не одиноки. Большинство из нас редко имеют дело с этими терминами, если только мы не ремонтируем водонагреватель или не устанавливаем аккумуляторы для вашего автомобиля или лодки. Так что, если вы ищете статью, в которой разъясняется разница простым языком, не ищите дальше. Здесь мы обсудим, что такое анод, что такое катод, как они оба работают и где они используются.
Начнем!
Попытка понять, как работают батареи, может показаться изучением другого языка.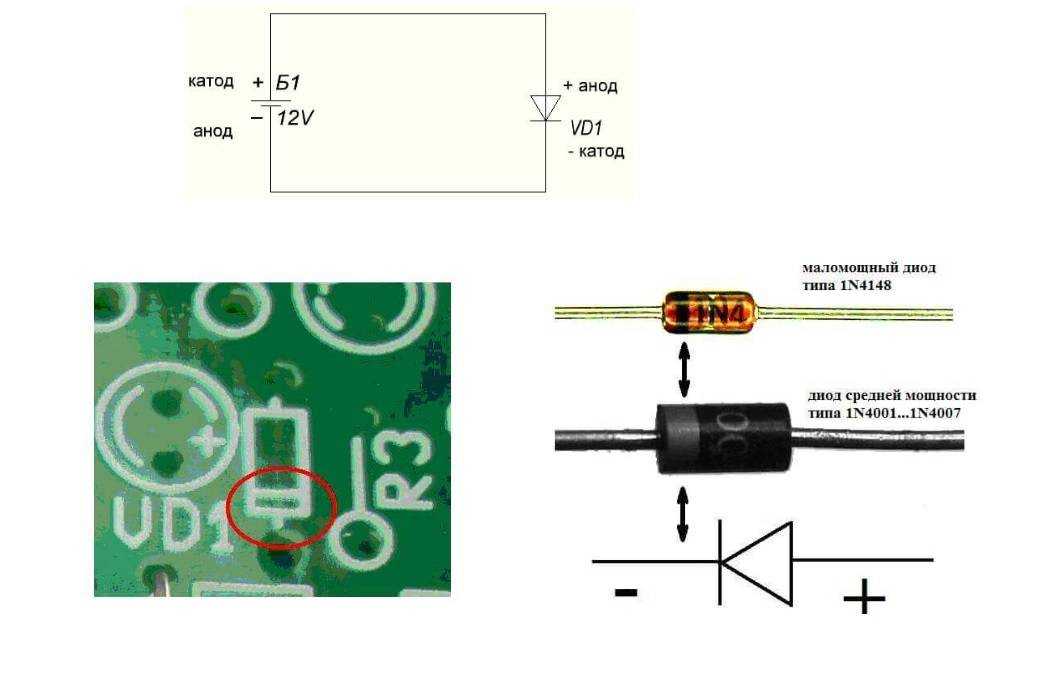 Ниже мы анализируем компоненты, которые потребуются аккумулятору для зарядки и излучения энергии (в понятной форме).
Ниже мы анализируем компоненты, которые потребуются аккумулятору для зарядки и излучения энергии (в понятной форме).
Анод — это отрицательный электрод, одна из основных частей батареи. Обычно он сделан из металла, который окисляется и посылает электроны катоду (положительному электроду). Это электрохимическая реакция, в результате которой образуются электроны (то есть электричество).
Материал анода для ионно-литиевых аккумуляторовАнод представляет собой окисляющийся металл, такой как цинк или литий, что означает, что он теряет электроны. Он находится в растворителе электролита и медленно разрушается по мере движения электронов по проводнику к катоду.
Проводник (будь то металлическая проволока или трубка) — это то, как мы получаем электричество, вырабатываемое анодом, и, в конечном счете, то, как батарея питает наши устройства. Как только анод полностью разрушается, батарея умирает (или теряет заряд).
Аноды могут изготавливаться из различных материалов.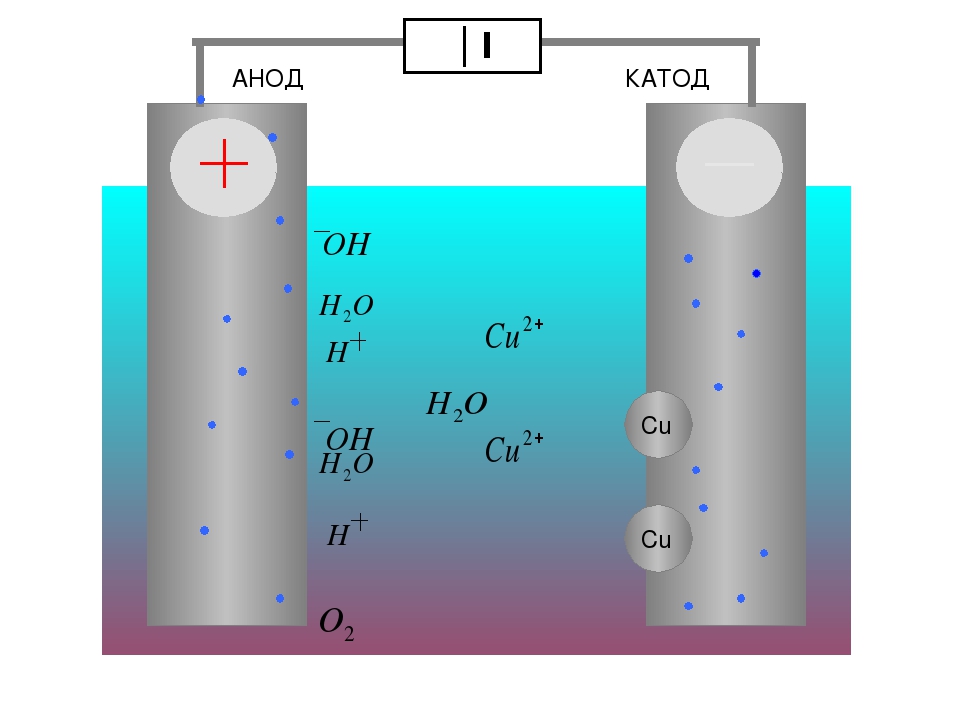 К ним относятся цинк, литий, графит или платина. Хороший анод должен быть эффективным восстановителем, обладать хорошей проводимостью, стабильностью и высоким кулоновским выходом (выходом электрической энергии).
К ним относятся цинк, литий, графит или платина. Хороший анод должен быть эффективным восстановителем, обладать хорошей проводимостью, стабильностью и высоким кулоновским выходом (выходом электрической энергии).
Как и анод, катод также является одним из электродов в батарее. Однако катод называют положительным электродом, потому что он не теряет электроны, а приобретает их. Следовательно, аноды окисляются (теряют электроны), а катоды восстанавливаются (приобретают электроны).
Материал катода для ионно-литиевых аккумуляторовПо сути, катод предназначен для приема электронов от анода. И анод, и катод погружены в раствор электролита, и электричество проходит по проводнику от отрицательной к положительной части вашей батареи. Это, в двух словах, то, как батарея вырабатывает электричество.
Чтобы увидеть, как работает катод, щелкните здесь, чтобы посмотреть короткое, но фантастическое видео, объясняющее этот процесс.
Катод может быть любым материалом при условии, что это эффективный окислитель, стабильный при контакте с электролитом. Из оксидов металлов получаются отличные катодные материалы, поскольку они также обладают полезным рабочим напряжением. К ним относятся оксид меди, оксид лития и графический оксид.
Из оксидов металлов получаются отличные катодные материалы, поскольку они также обладают полезным рабочим напряжением. К ним относятся оксид меди, оксид лития и графический оксид.
Анод и катод. Другими словами: как вы отличите их друг от друга на вашей батарее?
На самом деле это очень просто. Большинство аккумуляторов для жилых автофургонов, автомобилей и даже бытовых аккумуляторов имеют знак плюс (+) и минус (-) на каждом конце. Поскольку анод является отрицательным электродом (и, следовательно, теряет электроны), знак минус относится к аноду. С другой стороны, знак плюс относится к катоду, потому что это положительный электрод (и, таким образом, он получает электроны).
Важно понимать разницу между анодом и катодом, потому что вы можете точно понять, как работают ваши батареи, независимо от того, находитесь ли вы на лодке или водите прогулочный автомобиля или даже просто заменить батарейки в пульте дистанционного управления. Независимо от того, устанавливаете ли вы свою собственную солнечную установку или заменяете батареи, вы будете уверены в своих способностях правильно установить источник питания вашего устройства.
Независимо от того, устанавливаете ли вы свою собственную солнечную установку или заменяете батареи, вы будете уверены в своих способностях правильно установить источник питания вашего устройства.
Это также полезно, когда вы запускаете машину. Вы когда-нибудь ломали голову, пытаясь понять, куда вам нужно прикрепить зажимы кабеля усилителя? Теперь вы знаете: один подключается к отрицательному концу (анод), а другой — к положительному концу (катод).
Аноды и катоды играют роль не только в батареях, но и в других местах. Например, на кораблях есть «жертвенные аноды», которые действуют как защитное средство для катода, который является исходным материалом, который необходимо защищать от коррозии.
Вы также найдете аноды в бытовых приборах. Водонагреватели имеют жертвенные анодные стержни, которые продлевают срок службы водонагревателя. По сути, анодный стержень притягивает минералы, содержащиеся в воде, и разрушает сам резервуар. Отсюда и название «жертвенный».
Отсюда и название «жертвенный».
Аноды также могут помочь защитить резервуары для жидкости и трубы от коррозии — всегда для защиты катода (то есть важного материала, который производители хотят сохранить).
Большинство из нас понятия не имеют, что такое анод или катод, просто потому, что мы не имеем дело с этими терминами в повседневной жизни. Однако, если у вас есть автомобиль, транспортное средство для отдыха, лодка, любите возиться или просто хотите узнать, как все работает, полезно ознакомиться с анодами и катодами.
В конце концов, они есть в ваших батареях, водонагревателе и многих других местах в вашей повседневной жизни!
Есть вопросы по анодам и катодам? Оставьте их в комментариях ниже.
В электрохимических элементах, полупроводниковых диодах и в некоторых медицинских устройствах электроды используются в качестве проводника, который проводит электричество от неметаллических частей цепей. Другими словами, можно сказать, что электрод — это вещество, проводящее электричество в электрическом токе, который либо входит, либо выходит из неметаллической среды подобно электролиту. Анод и катод — это два типа электродов. Анод — это электрод, с которого поляризованный ток поступает во внешнюю цепь, а катод — это электрод, с которого поляризованный электрический ток выходит из поляризованного электрического устройства. Заряды анода и катода соответственно положительные и отрицательные. Символы анода и катода соответственно A и K.
Другими словами, можно сказать, что электрод — это вещество, проводящее электричество в электрическом токе, который либо входит, либо выходит из неметаллической среды подобно электролиту. Анод и катод — это два типа электродов. Анод — это электрод, с которого поляризованный ток поступает во внешнюю цепь, а катод — это электрод, с которого поляризованный электрический ток выходит из поляризованного электрического устройства. Заряды анода и катода соответственно положительные и отрицательные. Символы анода и катода соответственно A и K.
Слово «анод» происходит от греческого слова «аноды», что означает «вверх», а слово «катод» происходит от другого греческого слова «катоды», что означает «вниз».
Электрохимическая ячейка
Анод и катод — это электроды, используемые в электролитической ячейке и электрохимической ячейке. Знак анода и катода положительный и отрицательный. A и K являются соответствующими символами анода и катода.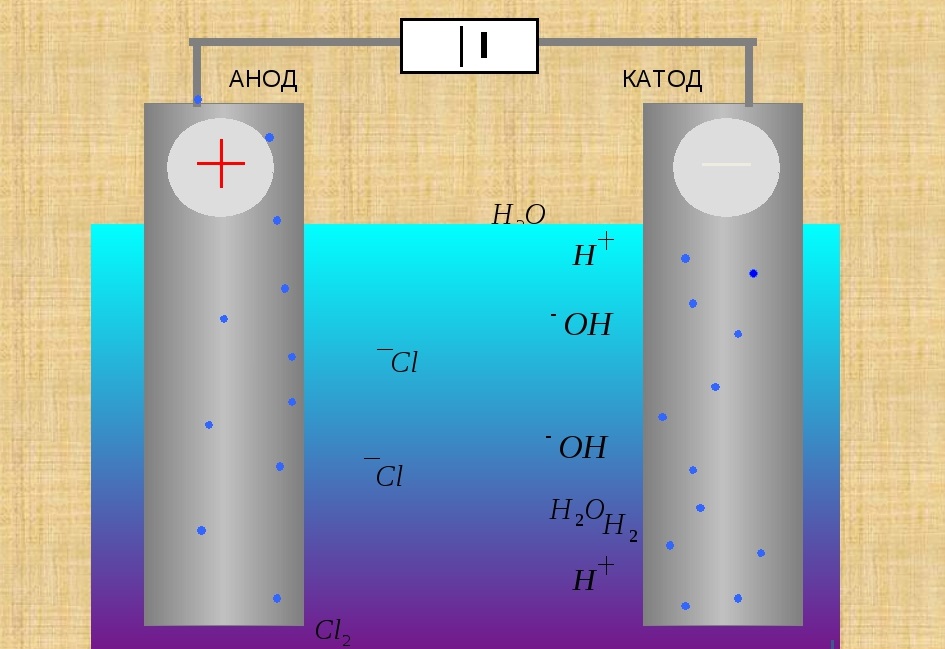 Детали анода и катода приведены ниже.
Детали анода и катода приведены ниже.
Как правило, анод — это электрод, на котором происходит реакция окисления, что означает, что на аноде электроны выделяются во внешнюю цепь. В электролитической ячейке анодом является положительный электрод, а в гальванической ячейке — отрицательный. знак анода ‘+’
В электролитической ячейке, которая использует электрическую энергию для распространения химической реакции, В гальванических или электрохимических ячейках, которые производят электрическую энергию в результате химической реакции, анод отрицательный, так как отрицательный потенциал по сравнению с раствором. Анод гальванического элемента представляет собой металлический цинк, погруженный в раствор ZnSO4. Металл Zn окисляется до Zn2+ и отдает два электрона во внешнюю цепь.
Обычно катод представляет собой электрод, на котором протекает реакция восстановления.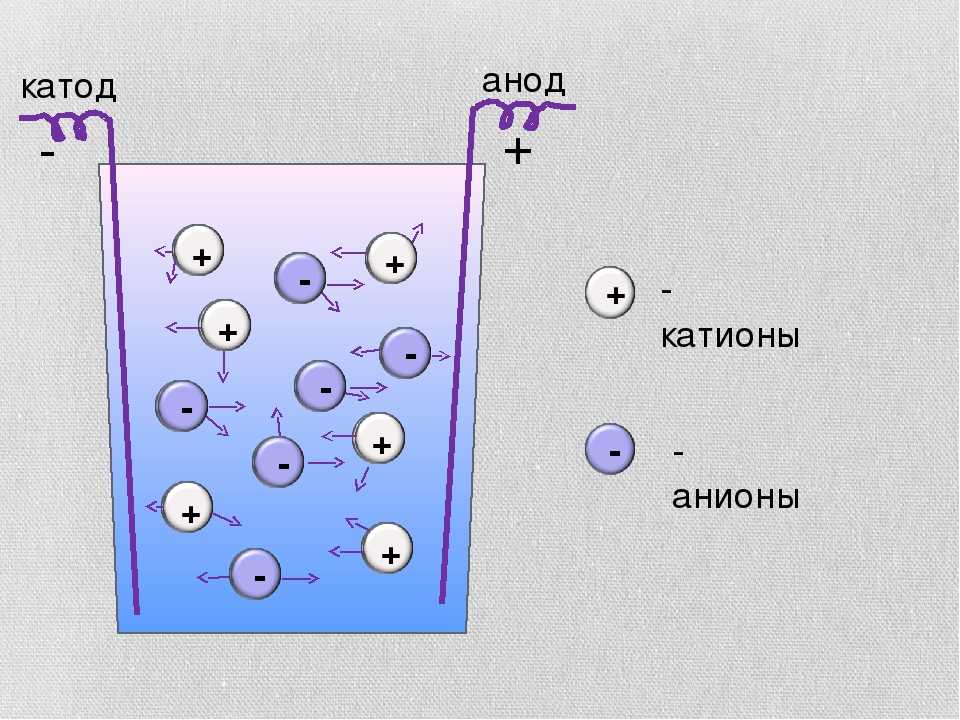 Это означает, что катод получает электроны из внешней цепи и восстанавливается. Знак катода «-».
Это означает, что катод получает электроны из внешней цепи и восстанавливается. Знак катода «-».
В гальванических элементах медь представляет собой катод, погруженный в раствор CuSO4. Ионы Cu2+ принимают электроны от внешней ячейки, восстанавливаются до металлического Cu и осаждаются на катоде.
Существует два типа катодов: горячий катод и холодный катод. Холодные катоды — это катоды, которые не нагреваются электрически нити накала. Который испускает больше электронов, чем может дать термоэлектронная эмиссия. Горячие катоды нагреваются электрическим током, проходящим через нить накала. Холодный катод используется в газоразрядных лампах, разрядных трубках и некоторых электронных лампах.
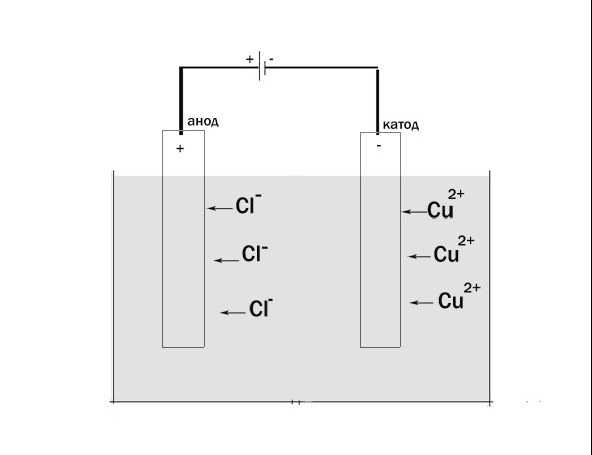
Во время электролиза происходит химическая реакция или изменение при прохождении электричества по цепи, а электролитическая ячейка представляет собой устройство, которое преобразует электрическую энергию в химическую. Заряд аниона и катиона в электролитической ячейке соответственно положительный и отрицательный. Рассмотрим электролиз расплавленного NaCl.
Заряд аниона и катиона в электролитической ячейке соответственно положительный и отрицательный. Рассмотрим электролиз расплавленного NaCl.
Анод провода или пластины имеет чрезмерный положительный заряд, так как он подключен к положительной клемме батареи. Следовательно, анионы будут стремиться двигаться к аноду, отдавать электроны аноду и окисляться. Эти электроны отдаются анионам, переходят во внешнюю цепь. При электролизе расплавленного NaCl два инертных электрода погружают в расплавленный раствор NaCl. Когда электричество проходит, анод приобретает избыточный положительный заряд, и ионы хлора из раствора движутся к аноду, где окисляются до металлического натрия.
Катод соединяется с отрицательной клеммой аккумулятора и содержит избыточный отрицательный заряд. Катионы из раствора движутся к нему и восстанавливаются, принимая электроны из внешней цепи. И наоборот, в гальванических элементах катион является положительным электродом. Когда расплавленный NaCl подвергается электролизу при пропускании электричества, ионы Na+ начинают двигаться к катоду, где он восстанавливается до металлического натрия.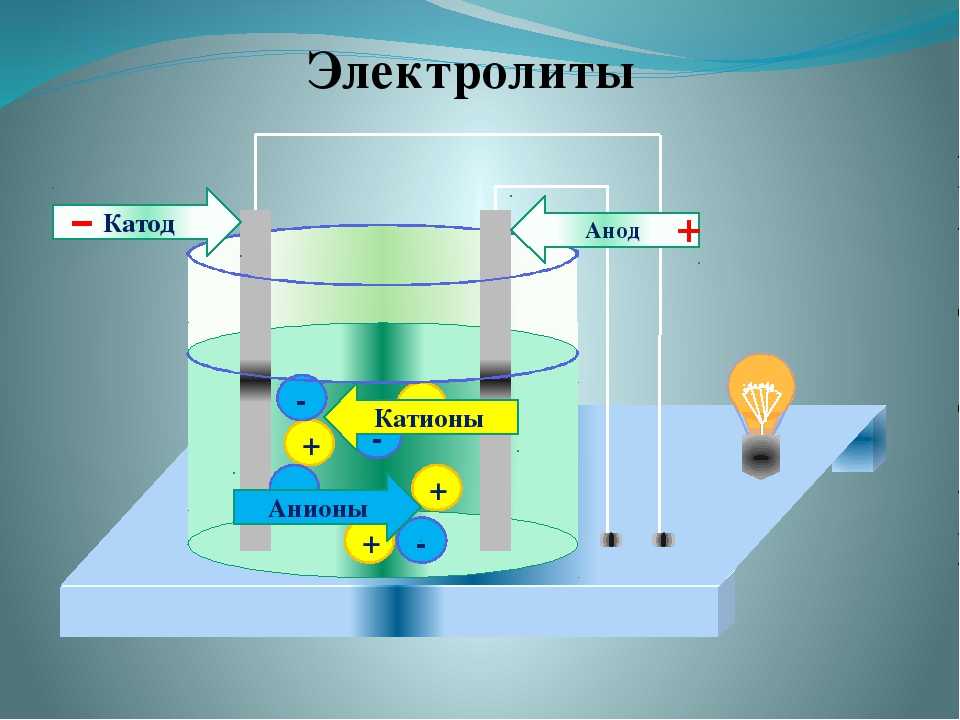
Анод | Катод |
В аноде протекает реакция окисления. | При восстановлении протекает реакция. |
Заряд анода в электролизере положительный. | Заряд катода в электролизере отрицательный. |
Электричество поступает в анод | Электричество выходит из катода. |
Анод обычно представляет собой положительную сторону элемента. | Катод обычно представляет собой отрицательную сторону элемента. |
В гальваническом элементе заряд анода отрицательный. | В гальваническом элементе заряд катода положительный. |
Анод и катод — это электроды, используемые для изготовления электролитических и электрохимических элементов.