
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.

Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
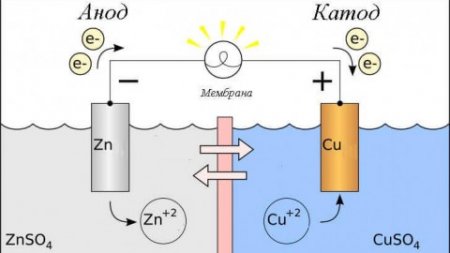
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
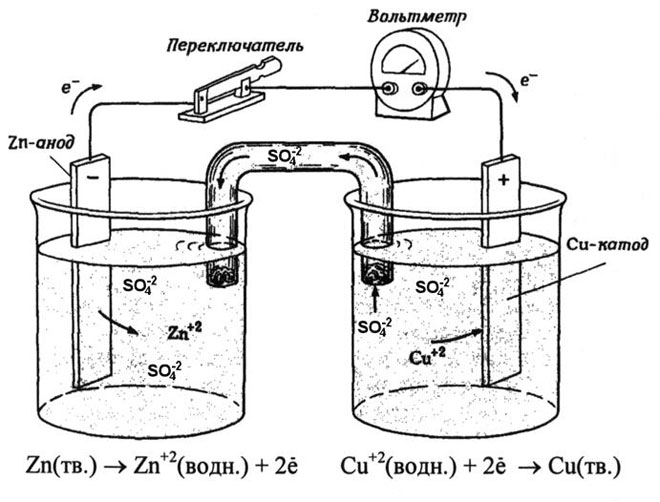

Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному. Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Аноды и катоды принимают участие во многих химических реакциях:
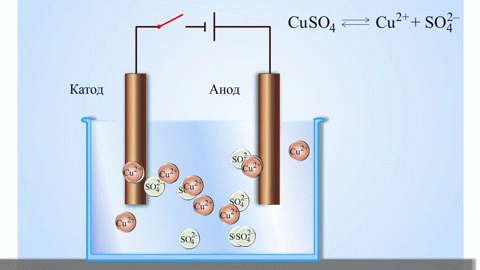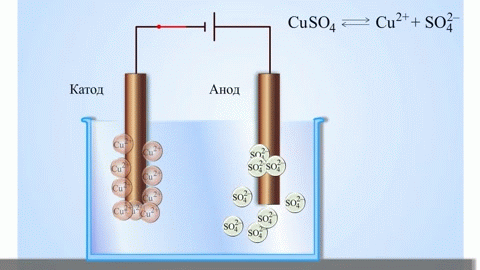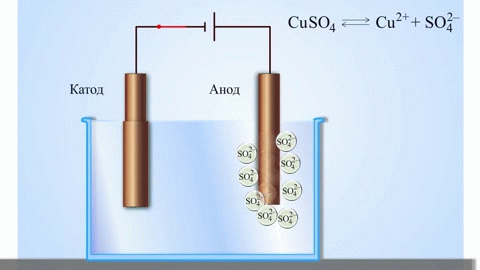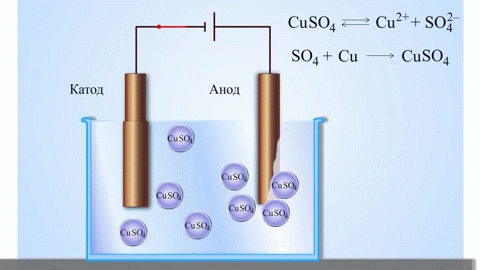
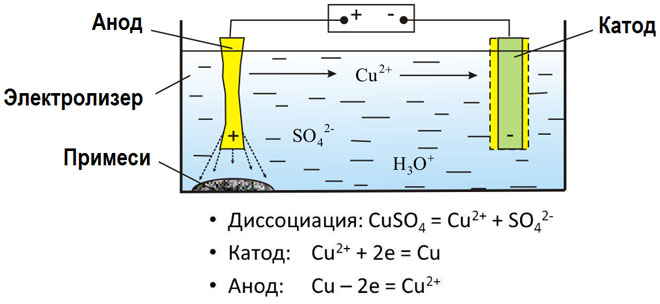
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.

Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.


Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла.


Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
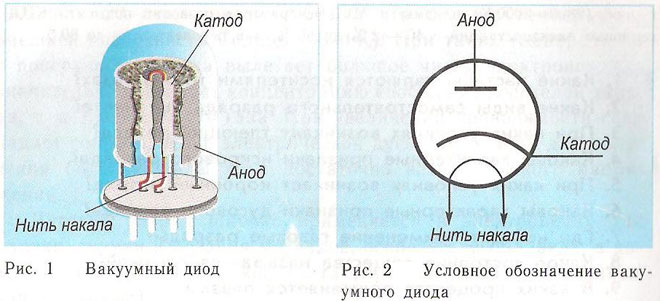

Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.

Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.


При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
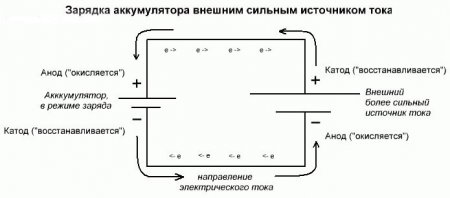
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
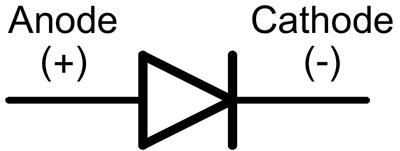
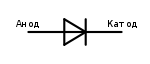
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
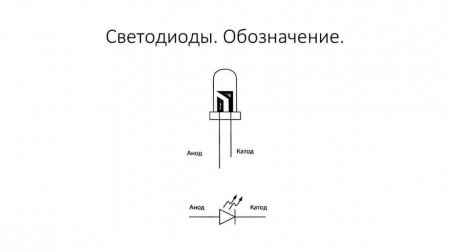
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.


Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
Простое объяснение понятий анод и катод. Как их легко определить и запомнить.
В электрохимии есть два основных раздела:
Рассмотрим окислительно-восстановительную реакцию в гальваническом элементе, тогда какие процессы протекают на его электродах?
Отсюда возникает вопрос – где плюс, а где минус у батарейки? Исходя из определения, у гальванического элемента анод отдаёт электроны.
Важно! В ГОСТ 15596-82 дано официальное определение названий выводов химических источников тока, если кратко, то плюс на катоде, а минус на аноде.
В данном случае рассматривается протекание электрического тока по проводнику внешней цепи от окислителя (катода) к восстановителю (аноду). Так как электроны в цепи текут от минуса к плюсу, а электрический ток наоборот, тогда катод – это плюс, а анод – это минус.
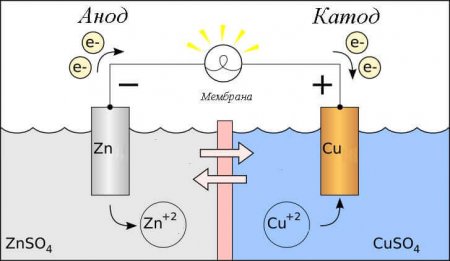
Внимание: ток всегда втекает в анод!
Или то же самое на схеме:

Эти процессы похожи и обратны гальваническому элементу, поскольку здесь не энергия поступает за счет химической реакции, а наоборот – химическая реакция происходит за счет внешнего источника электричества.
В этом случае плюс источника питания всё также называется катодом, а минус анодом. Зато контакты заряжаемого гальванического элемента или электроды электролизера уже будут носить противоположные названия, давайте разберемся почему!
Важно! При разряде гальванического элемента анод – минус, катод – плюс, при зарядке наоборот.
Так как ток от плюсового вывода источника питания поступает на плюсовой вывод аккумулятора – последний уже не может быть катодом. Ссылаясь на вышесказанное можно сделать вывод, что в этом случае электроды аккумулятора при зарядке условно меняются местами.
Тогда через электрод заряжаемого гальванического элемента, в который втекает электрический ток, называют анодом. Получается, что при зарядке у аккумулятора плюс становится анодом, а минус катодом.
Процессы осаждения металлов в результате химической реакции под воздействием электрического тока (при электролизе) называют гальванотехникой. Таким образом мир получил посеребренные, золоченные, хромированные или покрытые другими металлами украшения и детали. Этот процесс используют как в декоративных, так и в прикладных целях – для улучшения стойкости к коррозии различных узлов и агрегатов механизмов.
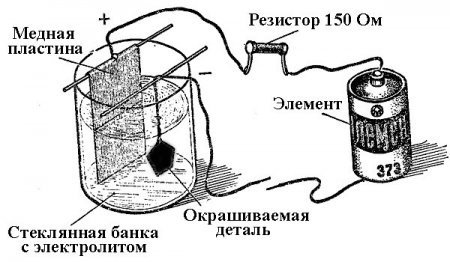
Принцип действия установок для нанесения гальванического покрытия лежит в использовании растворов солей элементов, которыми будут покрывать деталь, в качестве электролита.
В гальванике анод также является электродом, к которому подключаются плюсовой вывод источника питания, соответственно катод в этом случае – это минус. При этом металл осаждается (восстанавливается) на минусовом электроде (реакция восстановления). То есть если вы хотите сделать позолоченное кольцо своими руками – подключите к нему минусовой вывод блока питания и поместите в ёмкость с соответствующим раствором.
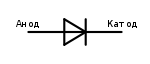
Электроды или ножки полупроводниковых и вакуумных электронных приборов тоже часто называют анодом и катодом. Рассмотрим условное графическое обозначение полупроводникового диода на схеме:

Как мы видим, анод у диода подключается к плюсу батареи. Он так называется по той же причине – в этот вывод у диода в любом случае втекает ток. На реальном элементе на катоде есть маркировка в виде полосы или точки.
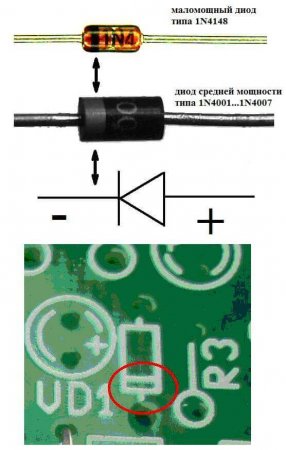
У светодиода аналогично. На 5 мм светодиодах внутренности видны через колбу. Та половина, что больше — это катод.
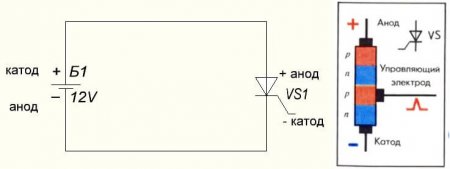
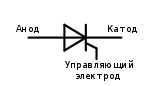
Также обстоит ситуация и с тиристором, назначение выводов и «однополярное» применение этих трёхногих компонентов делают его управляемым диодом:
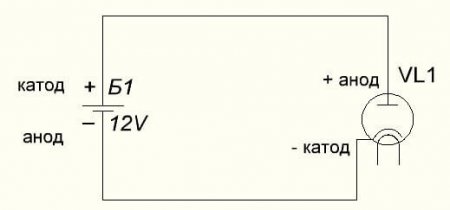
У вакуумного диода анод тоже подключается к плюсу, а катод к минусу, что изображено на схеме ниже. Хотя при приложении обратного напряжения – названия этих элементов не изменятся, несмотря на протекание электрического тока в обратном направлении, пусть и незначительного.
С пассивными элементами, такими как конденсаторы и резисторы дело обстоит иначе. У резистора не выделяют отдельно катод и анод, ток в нём может протекать в любом направлении. Вы можете дать любые названия его выводам, в зависимости от ситуации и рассматриваемой схемы. У обычных неполярных конденсаторов также. Реже такое разделение по названиям контактов наблюдается в электролитических конденсаторах.

Итак, подведем итоги, ответив на вопрос: как запомнить где плюс, где минус у катода с анодом? Есть удобное мнемоническое правило для электролиза, заряда аккумуляторов, гальваники и полупроводниковых приборов. У этих слов с аналогичными названиями одинаковое количество букв, что проиллюстрировано ниже:
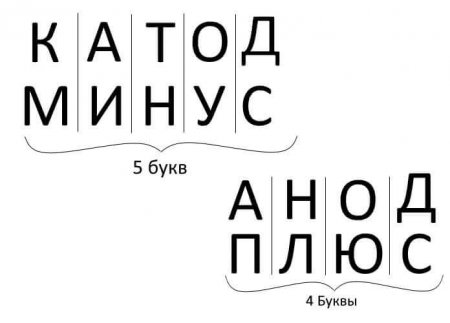
Во всех перечисленных случаях ток вытекает из катода, а втекает в анод.
Пусть вас не собьёт с толку путаница: «почему у аккумулятора катод положительный, а когда его заряжают – он становится отрицательным?». Помните у всех элементов электроники, а также электролизеров и в гальванике – в общем у всех потребителей энергии анодом называют вывод, подключаемый к плюсу. На этом отличия заканчиваются, теперь вам проще разобраться что плюс, что минус между выводами элементов и устройств.
Напоследок рекомендуем просмотреть полезное видео по теме статьи:
Теперь вы знаете, что такое анод и катод, а также как запомнить их достаточно быстро. Надеемся, предоставленная информация была для вас полезной и интересной!
Материалы по теме:
 0)Не нравится
0)Не нравится 0)
0)



Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода.
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.

В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
В литературе встречается различное обозначение знака анода — «+» или «-», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течет от анода к катоду, электроны, соответственно, наоборот.





Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.
Анод и катод — два физических термина прикладной электроники, гальванотехнике и химии. Уяснив эти термины, можно понять, почему, например, греется аудиоплеер. Путаница в терминологии спровоцирует аварийные ситуации.
Катоды и аноды — электрические проводники, которые имеют электронную проводимость. Посредством анода электрический заряд втекает в аппаратуру, а катода — наоборот, истекает. На первом возникает окислительная реакция (называют восстановитель) и отсылает заряженные частицы, на втором — восстановительная реакция (называют окислитель) и принимает заряженные частицы.
 Анод и катод в диоде
Анод и катод в диодеЕсли перемещение электрических проводников проходит от восстановления к окислению по цепи извне, возникает источник электроэнергии. Прибор, с помощью которого преобразовывается химическая энергия в электроэнергию, получил название «гальванический элемент».
Чтобы не возникло путаницы, стоит четко усвоить и запомнить отличие плюса и минуса в разных процессах:
В гальванотехнике химические реакции происходят внутри элемента. В электричестве извне не нуждается, так как заряд сам потечет во внешнюю цепь из элемента. В этом случаев катод — положительный, анод — отрицательный.
 Схема гальванического элемента
Схема гальванического элементаВ электролизе необходим внешний источник тока, включенный в разрыв проводника внешней цепи. Внешний источник создаст разность потенциалов между электрическими проводниками, и вне устройства будет вкачивать ток в элемент. На аноде будет плюс, а на катоде — противоположно.
Важно! Чтобы определить, катод и анод — это плюс или минус, нужно запомнить: в гальванотехнике отрицательным становится анод, а катод — положительный. У электролитов — противоположно.
Особенность диодов такова, что они проводят заряд только в одном направлении. Чтобы не ошибиться, обычно на корпусе обозначены маркировки. В случае отсутствия маркировок чтобы узнать, как все-таки определить полярности анода и катода у диодов, применяют следующие методы.
Обратите внимание! Если включить лампочку, и она начнет гореть — «+» батарейки соединен с положительной полярностью, это есть анод, и прибор будет пропускать через себя ток. Если свет не загорелся, то значит, соединили с отрицательной полярностью — это катод и, соответственно, тока не будет.
 Определение полюсов с помощью лампочки
Определение полюсов с помощью лампочкиЕсли взглянуть на аккумулятор или обычные батарейки, то можно заметить терминалы, отличающиеся обозначением «+» и «-», которые расположены на противоположных концах.
Аккумулятор имеет металлический или пластиковый каркас. Внутри катод сведен с положительной полярностью, а анод подключен к отрицательной полярности. Отделяет их друг от друга заслон, поэтому они не соприкасаются, а электрический заряд свободно протекает между ними. Помогает этому электролит — специальный раствор серной кислоты.
 Схема заряда АКБ
Схема заряда АКБКогда проходит химическая реакция заряда с электролитом на одном из электрических проводников, возникнет окислительная реакция. Если включить гальванический компонент в электросеть, электроны с анода перетекут на катод, производя функционирование пока в электролите возникают химические взаимодействия. Работать химический источник электрического тока прекратить только тогда, когда химические составляющие электролита израсходуются.
На заметку. Когда происходит разряд гальванического элемента, то анод является «-», когда заряд — катод имеет знак «+».
В электронике применяют особенности диодов впускать заряд по прямому маршруту, но не отпускать обратно.
 Р-n переход тока
Р-n переход токаРабота светодиода заключается в свойстве кристаллов, которые светятся при пропускании через p-n переход тока по прямой.
В электрохимии электрические проводники необходимы при создании автономных источников питания (аккумуляторные батареи), а также при воспроизведении технологических процессов. Аноды, катоды участвуют в электролизе, электроэкстракции, гальваностегии и гальванопластике.
Гальваника — восстановления металла при химических процессах под воздействием электротока. Такая процедура приводит к устойчивости от коррозии узлов и агрегатов механизмов.





Ано́д (др.-греч. ἄνοδος — движение вверх) — электрод некоторого прибора, присоединённый к положительному полюсу источника питания. Электрический потенциал анода положителен по отношению к потенциалу катода (кроме гальванических элементов).[источник не указан 1317 дней]
При процессах электролиза (получение элементов из солевых растворов и расплавов под действием постоянного электрического тока), анод — электрически положительный полюс, на нём происходят окислительно-восстановительные реакции (окисление), результатом которых, в определённых условиях, может быть разрушение (растворение) анода, что используется, к примеру, при электрорафинировании металлов.
Аноды — множественное число слова «анод»; эта форма применяется преимущественно в металлургии, где применяются аноды для гальваники, используемые для нанесения на поверхность изделия слоя металла электрохимическим способом, либо для электрорафинирования, где металл с примесями растворяется на аноде и осаждается в очищенном виде на катоде. Основное распространение получили аноды из цинка (бывают сферические, литые и катаные, чаще используются последние), никеля, меди (среди которых отдельно выделяют медно-фосфористые, марки АМФ), кадмия (применение которых сокращается из-за экологической вредности), бронзы, олова (применяются при производстве печатных плат в радиоэлектронной промышленности), сплава свинца и сурьмы, серебра, золота и платины. Аноды из недрагоценных металлов применяются для повышения коррозионной стойкости, повышения эстетических свойств предметов и др. целей. Аноды из драгоценных металлов применяются гальваническим производством для повышения электропроводности изделий и др.
Кроме принудительной организации полезных электрохимических процессов, аноды применяются и для защиты от последствий нежелательных, побочных электрохимических процессов.
В вакуумных электронных приборах анод — электрод, который притягивает к себе летящие электроны, испущенные катодом. В электронных лампах и рентгеновских трубках конструкция анода такова, что он полностью поглощает электроны. А в электронно-лучевых приборах анод является элементом электронной пушки. Он поглощает лишь часть летящих электронов, формируя после себя электронный луч.
Электрод полупроводникового прибора (диода, тиристора), подключённый к положительному полюсу источника тока, когда прибор открыт (то есть имеет маленькое сопротивление), называют анодом, подключённый к отрицательному полюсу — катодом.
В литературе встречается различное обозначение знака анода — «+» или «−», что определяется, в частности, особенностями рассматриваемых процессов.
В электрохимии принято считать, что катод — электрод, на котором происходит процесс восстановления, а анод — тот, где протекает окисление[1]. При работе электролизера (например, при рафинировании меди) внешний источник тока обеспечивает на одном из электродов избыток электронов (отрицательный заряд), здесь происходит восстановление металла, это катод. На другом электроде обеспечивается недостаток электронов и окисление металла, это анод.
В то же время при работе гальванического элемента (к примеру, медно-цинкового), избыток электронов (и отрицательный заряд) на одном из электродов обеспечивается не внешним источником тока, а собственно реакцией окисления металла (растворения цинка), то есть здесь отрицательным, если следовать приведённому определению, будет уже анод. Электроны, проходя через внешнюю цепь, расходуются на протекание реакции восстановления (меди), то есть катодом будет являться положительный электрод.
В соответствии с таким толкованием, для аккумулятора анод и катод меняются местами в зависимости от направления тока внутри аккумулятора[2][3].
В электротехнике анод — положительный электрод, ток течёт от анода к катоду, электроны, соответственно, наоборот.